Abstract: In the present study, the ability of 5 not previously studied types of deuteromycetes from the collection of FGBNU VILAR to hydrolyze different collagen substrates was investigated by screening method during surface cultivation. The native collagen and the modified protein, having increased resistance to proteolysis, as an additional factor in the evaluation of proteolytic activity of microorganisms were used. The possibility of adaptation of all deuteromycetes proteolytic systems for the modified collagen using as the substrate was shown. A comprehensive study of the diameters of the colonies, zones of lysis, growth rates and indexes of lysis of 5 micromycetes from biocollection FGBNU VILAR using native and modified collagen showed the greatest proteolytic potential of Aspergillus niger (F 51), Cladosporium herbarum (F 33) and Penicillium claviforme (F 32) cultures. These cultures are promising for use as producers of proteases.
Keywords: fungi, collagenolytic activity, modified protein
Различные ферменты давно и достаточно широко используются в медицинской практике для энзимодиагностики, энзимотерапии, в медицинских технологиях и промышленности. Микробиологический синтез ферментов имеет ряд преимуществ, таких как неограниченность источников получения БАВ, возможность экзогенной регуляции, отсутствие прионов. Среди протеолитических ферментов особое внимание привлекает коллагеназа – эндопептидаза, расщепляющая тройную спираль молекулы нерастворимого природного белка коллагена [1]. Коллагеназа может найти широкое применение во многих областях медицины [2-6]: в хирургии, терапии, гинекологии, стоматологии, а также в косметологии (антивозрастные средства). В связи с этим поиск новых продуцентов остается достаточно актуальной задачей. Ранее нами были разработаны подходы, позволяющие осуществлять поиск продуцентов коллагеназ и разработать методы их выделения [7, 8]. Использование при скрининге модифицированных субстратов, обладающих повышенной устойчивостью к протеолизу, является дополнительным критерием при отборе потенциальных продуцентов [9]. Целью настоящей работы являлась оценка коллагенолитической активности ранее не изученных микромицетов с использованием модифицированного и немодифицированного коллагена.
Культуры Aspergillus niger F 51, Cladosporium herbarum F 33, Monilia implicata F 15, Penicillium claviforme F 32 и Phialophora verrucosa F 12 выращивали на скошенной поверхности агаризованной среды Чапека следующего состава (%): NaNO3 – 0,2; KH2PO4 — 0,1; MgSO4 x 7H2О – 0,05; KCl – 0,05; FeSO4x 7H2O – 0,001; CaCO3 – 0,3; сахароза – 2; агар – 2, (рН 6,8) в течение 7-ми суток в термостате при 260С. Для проведения поверхностного культивирования использовали агаризованные среды, содержащие солевой фон среды Чапека с заменой сахарозы на 2% нативного и модифицированного коллагена, полученного так, как это было описано нами ранее [9]. Протеолитическую способность микроорганизма оценивали по диаметру колоний на соответствующих субстратах после посева микромицета на агаризованную среду. Активность биосинтеза ферментов оценивали по индексу лизиса (I лиз): I лиз = D2лиз /D2кол, где Dлиз – диаметр зоны лизиса, Dкол – диаметр колонии.
Известно, что рост микроорганизмов на субстратах, содержащих белки в качестве единственного энергетического источника, позволяет судить об их потенциальной протеолитической активности. Появление зон лизиса белков вокруг колоний является показателем секреции ферментов в окружающую среду. В связи с этим на первом этапе исследования фиксировались диаметры колоний и диаметры зон лизиса при культивировании микромицетов на средах с заменой сахарозы на коллаген или модифицированный коллаген (табл. 1).
Таблица 1
Параметры роста микромицетов при поверхностном культивировании на средах с нативным и модифицированным коллагеном
| № культуры | Субстрат | Время культивирования, сутки | |||||||||
| 3 | 4 | 5 | 6 | 7 | |||||||
| Dк,
мм |
Dл,
мм |
Dк,
мм |
Dл,
мм |
Dк,
мм |
Dл,
мм |
Dк,
мм |
Dл,
мм |
Dк,
мм |
Dл,
мм |
||
| F 51 | кн | 11,2 | 19,0 | 14,5 | 28,5 | 18,0 | 32,3 | 21,8 | 40,0 | 21,3 | 55,0 |
| км | 9,5 | — | 13,2 | — | 16,5 | 20,0 | 21,8 | 25,8 | 24,5 | 32,2 | |
| F 33 | кн | 11,0 | 16,7 | 15,5 | 27,2 | 19,0 | 34,2 | 23,8 | 39,5 | 25,8 | 45,0 |
| км | 8,7 | — | 12,8 | 14,7 | 16,7 | 19,7 | 20,7 | 24,3 | 21,7 | 29,5 | |
| F 15 | кн | 15,8 | 16,8 | 21,2 | 23,5 | 25 | 27,3 | 27,3 | 27,3 | 28,8 | 28,8 |
| км | 2,0 | — | 6,0 | — | 12,3 | — | 20,0 | — | 23,0 | — | |
| F 32 | кн | 12,1 | 20,0 | 17,2 | 27,0 | 21,7 | 36,7 | 26,0 | 41,3 | 28,2 | 48,8 |
| км | 8,7 | — | 12,7 | — | 14,8 | 16,3 | 20,8 | 24,7 | 23,5 | 32,3 | |
| F 12 | кн | 14,8 | 17,0 | 19,7 | 21,3 | 24,7 | 31,5 | 29,8 | 41,0 | 35 | 45,8 |
| км | 9,8 | — | 13,7 | — | 18,5 | — | 25,2 | 27,5 | 29,2 | 32,8 | |
Примечание. Здесь и в таблицt 2 использованы следующие обозначения: Dк – диаметр колоний; Dл – диаметр зон лизиса; кн – нативный коллаген; км – модифицированный коллаген.
Культура A. niger F 51 росла значительно медленнее на среде, содержащей модифицированный коллаген, особенно на начальных этапах роста, значительно позднее начали образовываться и зоны лизиса. При этом диаметр зон лизиса при культивировании на модифицированном субстрате был меньше в 1,5 – 1.7 раза. Скорости роста культуры P. claviforme F 32 на средах, содержащих модифицированный и нативный коллаген, отличались примерно в такой же степени, как и в случае первой культуры.
Аналогичные закономерности наблюдались и при культивировании Ph. verrucosa F 12. При этом зоны лизиса на модифицированном субстрате образовывались на сутки позднее, и их размер был меньше зон лизиса на нативном коллагене в 1,2 – 1,4 раза. Однако необходимо отметить, что размер колоний при росте на обеих средах у этой культуры был наибольшим среди других исследованных дейтеромицетов.
Очень небольшие различия размеров зон лизиса при росте на модифицированных и немодифицированных средах, отмечались и при культивировании C. herbarum F 33. В некоторых случаях диаметры зон лизиса на модифицированном коллагене были сравнимы с теми же показателями, что и при росте на нативном. Кроме того, образование зон лизиса на модифицированной среде начиналось на более ранних сроках (4 сутки культивирования), чем у всех остальных культур.
Наибольшие различия при росте на указанных субстратах наблюдались у культуры M. implicate F 15. Зоны лизиса на модифицированном коллагене отсутствовали на всех этапах культивирования. При этом был значительно замедлен и рост колоний, особенно на начальных этапах.
Cкорость роста микроорганизмов в процессе культивировании на различных субстратах во многом определяет их адаптационный потенциал. В связи с этим нами исследовалось изменение средней за все время культивирования скорости роста для 5 видов изучаемых микромицетов при замене нативного коллагена на модифицированный (рис. 1). На нативном коллагене наибольшие скорости роста отмечались у Ph. verrucosa F 12 и M. implicata F 15и составляли 4,94 и 4,86 мм/сутки соответственно. Однако скорости роста и других культур были не на много ниже и лежали в диапазоне 4,18 – 3,52 мм/сутки
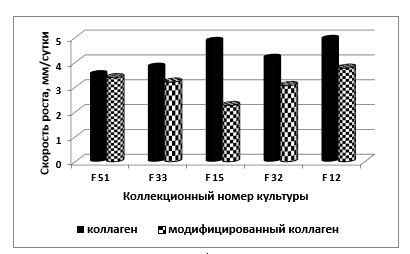
Рисунок 1. Средняя скорость радиального роста микромицетов на средах с разными белками
При использовании модифицированного, более устойчивого к протеолизу белка в среде у всех грибов, кроме A. niger F 51 наблюдалось снижение скорости роста, наибольшее у M. implicata F 15 в 2,4 раза. У трех других грибов снижение скорости было менее выражено и составляло 1,2 – 1,4 раза.
Индекс лизиса является интегральным показателем, который характеризует способности культуры секретировать ферменты, гидролизующие соответствующий субстрат. Указанный показатель определяется соотношением площади колонии и площади зоны лизиса и пропорционален удельной протеолитической активности культуры, так как площадь колонии пропорциональна ее биомассе, а площадь зоны лизиса – активности секретируемых протеиназ. В связи с этим на следующем этапе исследования были рассчитаны индексы лизиса микромицетов при росте на средах, содержащих нативный и модифицированный коллаген (табл. 2).
В процессе проведенного исследования выявлено, что у всех микромицетов индексы лизиса были существенно ниже при росте на модифицированном белке и регистрировались на более поздних этапах культивирования. При этом у M. implicata отсутствовали видимые зоны лизиса на модифицированном коллагене, и индексы лизиса на нативном субстрате были очень небольшими.
Таблица 2
Индексы лизиса микромицетов при росте на средах с нативным и модифицированным коллагеном
| Культура | Субстрат | Время культивирования, сутки | ||||
| 3 | 4 | 5 | 6 | 7 | ||
| A. niger
F 51 |
кн | 2,9 | 3,7 | 3,2 | 3,4 | 6,7 |
| км | 1 | 1 | 1,5 | 1,7 | 1,7 | |
| C. herbarum
F 33 |
кн | 2,3 | 3,1 | 3,3 | 2,8 | 3,0 |
| км | 1,0 | 1,3 | 1,4 | 1,4 | 1,8 | |
| M. implicata
F 15 |
кн | 1,1 | 1,2 | 1,2 | 1,0 | 1,0 |
| км | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | |
| P. claviforme
F 32 |
кн | 2,7 | 2,5 | 2,9 | 2,5 | 3,0 |
| км | 1,0 | 1,0 | 1,2 | 1,4 | 1,9 | |
| Ph. verrucosa
F 12 |
кн | 1,3 | 1,2 | 1,6 | 1,9 | 1,7 |
| км | 1,0 | 1,0 | 1,0 | 1,2 | 1,3 | |
Наибольший индекс лизиса при росте на нативном коллагене зафиксирован у A niger. Относительно высокий индекс лизиса отмечался также у P. claviforme и C. herbarum. При росте на средах с нативным коллагеном индекс лизиса превышал указанный показатель у двух других микромицетов на 7 сутки культивирования в 1,8 — 3,0 раза. При росте на модифицированном белке индекс лизиса менялся в значительно более узком интервале от 1,0 до 1,9. Средние индексы лизиса, рассчитанные за все время культивирования, менялись в следующем ряду: A.niger > C. herbarum > P. claviforme > Ph. verrucosa > M. implicata при росте на среде с нативным коллагеном и — C. herbarum > A.niger = P.claviforme > Ph. verrucosa > M. implicata – на средах с модифицированным коллагеном.
Комплексное изучение диаметров колоний, зон лизиса и индексов лизиса при поверхностном культивировании 5 микромицетов, относящихся к разным родам, на средах с нативным и модифицированным коллагеном показало, что наибольшим протеолитическим потенциалом обладают культуры Aspergillus niger F 51, Cladosporium herbarum F 33 и Penicillium claviforme F 32. Указанные культуры перспективны для дальнейшего изучения в качестве продуцентов коллагеназ.
References
1.Можина Н.В., Руденская Г.Н. Коллагенолитические ферменты патогенных микроорганизмов. // Биомедицинская химия – 2004. – Т. 50, № 6. – С. 539-5532.Alster N.S., Tansi E.L. Hypertrophic scars and keloids: etiology and management. // Am. J. Clin. Dermatol. – 2004. – V. 4, № 4. – P. 39-42.
3.Friedman K., Pollack S.V., Manning T., Pinnell S.R. Degradation of porcine dermal connective tissue by collagenase and hyaluronidase. // Br. J. Dermatol. – 1986. – V. 115, № 4. – P. 403-408.
4.Mutalir S. Treatment of keloids and hypertrophic scars. // Indian J. Dermatol. Venereol. Leprol. – 2005. - V. 71, № 1. – P. 3-8.
5.Neely A.N., Clendening C.E., Gardner J. Gelatinase activity in reloads and hypertrophic scars. // Wound Repair Regen. – 1999. – V. 7, № 3. – P. 166-171.
6.Peled Z.V., Phelbs E.D.,Updike D.L. Matrix metalloproteinases and the ontogeny of scarless repair: the other side of the wound healing balance. // Plast. Reconstr. Surg. – 2002. – V. 110, № 3. – P. 808-811.
7. Сухосырова Е.А., Никитина З.К., Яковлева М.Б., Вещикова Е.В., Быков В.А. Характеристика коллагенолитических ферментов, секретируемых дейтеромицетом Aspergillus flavus. // Бюлл. эксперим. биологии и медицины. - 2003. - Т. 35. - №5. - С. 526-530.
8.Яковлева М.Б., Зон Х.Ч., Никитина З.К., Быков В.А. Рост и синтез внеклеточных ферментов некоторыми видами дейтеромицетов, культивируемых на различных белковых субстратах // Вопросы биол., медиц. и фармацевтич. химии. – 2009. - №1. - С. 6-10.
9. Gordonova I.K., Nikitina Z.K. Search of proteinases secreting deuteromyces. // Materials of the X International research and practice conference "Science, Technology and Higher Education", Canada, April 28-29. 2016. - P.111-118.
